Il muscolo scheletrico, sottoposto al controllo volontario che troviamo classificato come facente parte dell’apparato locomotore, è costituito da una serie di unità dette fibre, raccolte in fasci che ne contengono un numero imprecisato e variabile. Le fibre sono formate da cellule muscolari, dette miofibrille, che sono rappresentate dal sarcomero, un’unità contrattile che contiene le proteine tipiche della contrazione muscolare. Sono orientate longitudinalmente e delimitate da due dischi detti “Z” dove avviene il loro slittamento.
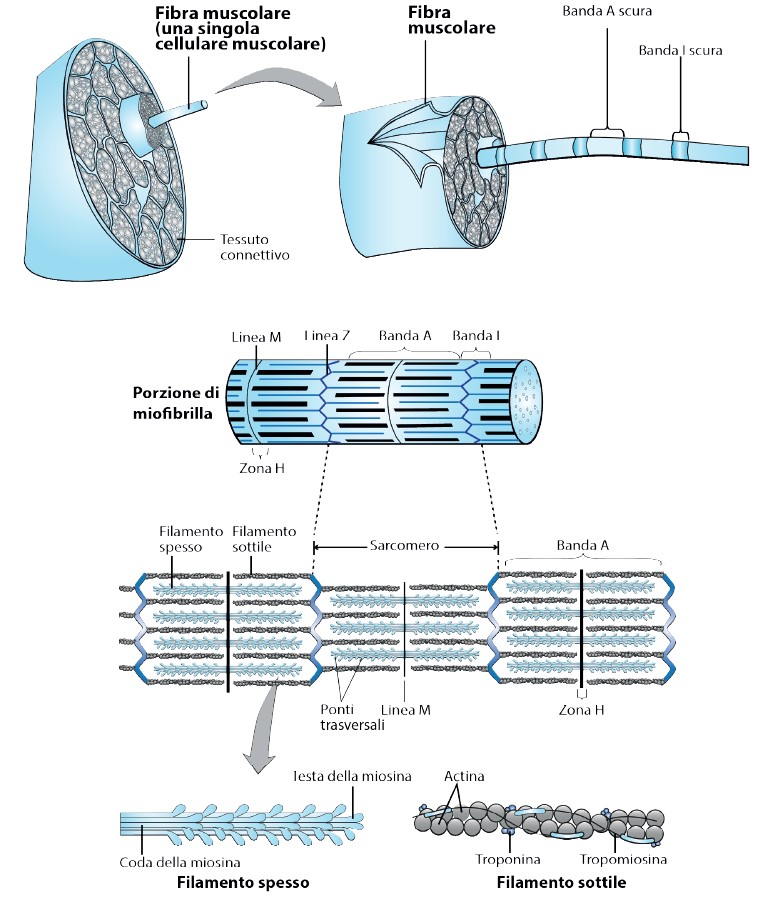
Le proteine contrattili sono quattro. La classificazione gerarchica qui adottata, tiene in considerazione l’importanza che tali proteine hanno in natura: quanto sono presenti e quanti individui le possiedono nel loro organismo.
La miosina
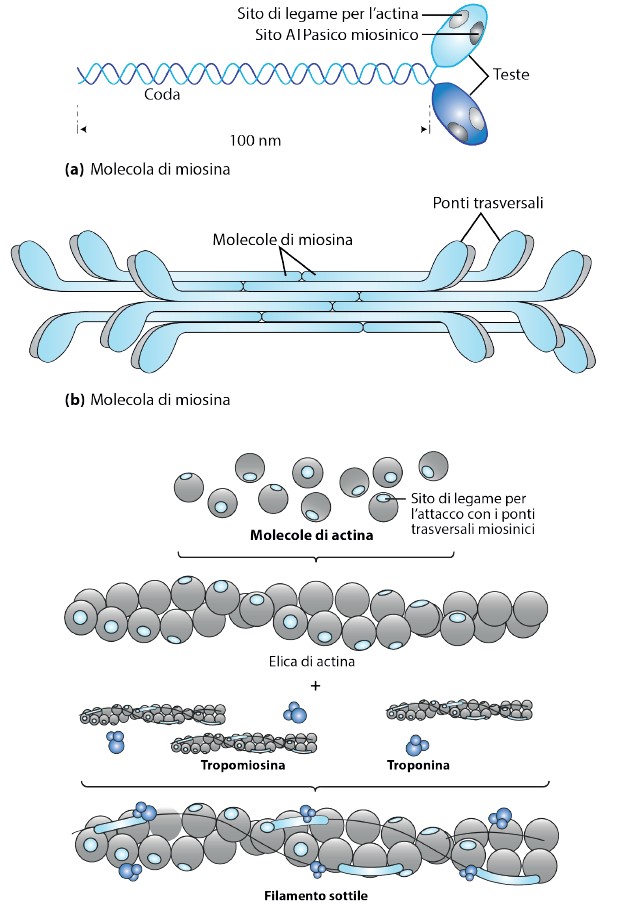
È la proteina contrattile per eccellenza. Ha un elevato peso molecolare e come tutte le proteine presenti in natura, è dotata di polarità. È composta da un’area filamentosa centrale e da una parte globulare terminale.
L’area filamentosa è formata da catene polipeptidiche di due tipi, due sono pesanti e quattro leggere. Quelle leggere determinano la specialità nella funzione della proteina, deputata a definire le proprietà funzionali specifiche nella muscolatura, sia per l’uomo che per gli animali.
Le catene sono formate da aminoacidi, che a loro volta sono composti peptidici costituiti da basi azotate formate da carbonio, azoto e idrogeno.
I peptidi formano i polipeptidi, che vanno a definire la base strutturale proteica, così come i mattoni per costruire una casa.
Dal punto di vista istologico, le aree centrali creano ponti trasversali attraverso i quali si legano con altre proteine contrattili, mentre le aree globulari strutturano i legami con l’actina e l’ATP.
L’actina
L’actina costituisce i filamenti sottili del sarcomero, è una proteina globulare, di forma simile ad una sfera (G-actina). Molte di queste molecole si associano tra loro per comporre lunghi e sottili granuli (detti F-actina). Due di queste catene si avvolgono eleicodalmente l’una sull’altra, dando origine al filamento sottile. Ogni molecola di G-actina contiene un sito di legame per la testa della miosina, che, in condizioni di riposo, si trova bloccato da due proteine.
I filamenti sottili sono infatti costituiti, oltre che dall’actina, da Troponina e Tropomiosina.
La troponina e la tropomiosina
Sia la troponina che la tropomiosina sono proteine contrattili che impediscono la contrazione muscolare, in quando mantengono ancorate le posizioni molecolari dell’actina rispetto la miosina. Il calcio ha un ruolo fondamentale, in quanto consente – agendo sulla troponina – di effettuare modifiche nella contrazione actino-miosina.
Tropomiosina: nel muscolo a riposo impedisce il contatto tra 7 molecole di G-actina e le rispettive teste di miosina, mantenendo il muscolo rilassato.
Troponina: quando lega il calcio cambia la propria conformazione e sposta la tropomiosina permettendo l’aggancio con la miosina.