Per obesità sarcopenica si intende la contemporanea coesistenza di obesità e poca massa muscolare/forza muscolare. Gli studi che hanno tentato di definire l’obesità sarcopenica hanno usato due parametri morfologico-antropometrici: massa muscolare scheletrica e superficie corporea (Stenholm et al., 2008).

In tabella sono riportati i valori antropometrici e di composizione corporea che classificano la sarcopenia e l’obesità secondo il NAHNES III e il New Mexico Aging Process Study. Rientrare in ambedue le classi definisce lo stato di obesità sarcopenica.
Conseguenza dell’obesità sarcopenica
Se la perdita di massa muscolare e l’obesità considerati singolarmente condizionano negativamente lo stato di salute, avere poca massa muscolare ed essere obesi allo stesso tempo la compromette seriamente; infatti l’associazione di obesità e sarcopenia determina più disabilità e rischio cardiovascolare rispetto all’essere solo obesi o solo sarcopenici (Stenholm et al., 2008; Chung et al., 2013).
Nel cancro, sarcopenia e obesità sarcopenica, nella maggior parte dei casi, sono condizioni occulte che sono state associate in modo indipendente con l’alta incidenza della tossicità chemioterapica, a tempi più brevi nella progressione del tumore, esiti peggiori della chirurgia, debilitazione fisica e minor sopravvivenza (Prado et al., 2016). Sebbene obesità e sarcopenia possano presentarsi singolarmente e non necessariamente insieme, vi è una connessione causale che lega l’obesità alla sarcopenia (Stenholm et al., 2008).
Di seguito alcuni fattori “causa-effetto” tra obesità e sarcopenia.
Sedentarietà
La sedentarietà è un importante fattore di rischio per sviluppare obesità; gli obesi sono tendenzialmente sedentari e questa condizione determina perdita di massa muscolare e forza, insulino resistenza, ed accumulo di grasso viscerale. Di rilievo è che la sedentarietà determina perdita di massa muscolare indipendentemente dal tipo di apporto nutrizionale; ciò è dovuto ad uno stato di “resistenza anabolica” che si crea verso i nutrienti in risposta al disuso muscolare.
In sostanza il disuso muscolare determina un sensibile decremento delle sintesi proteiche muscolari in condizioni post-assorbimento ma anche nelle fasi postprandiali. Ne consegue perdita di massa muscolare con relativo rallentamento del metabolismo di base ed energetico.
L’abbassamento del metabolismo produce ulteriore incremento di peso/grasso corporeo innescando così un circolo vizioso (Fiuza-Luces et al., 2013; Stenholm et al., 2008; Hunter et al., 2002; Rudrappa et al., 2016).
Infiammazione
Come si è visto finora, le citochine proinfiammatorie vengono rilasciate dal grasso viscerale quando questo aumenta le sue dimensioni. Vi è un’associazione positiva tra grasso viscerale e citochine proinfiammatorie, e cioè all’aumentare delle dimensioni del primo aumenta la produzione delle seconde. Altresì vi è associazione negativa tra citochine proinfiammatorie e massa muscolare, più aumentano le citochine più si perde massa muscolare.
In particolare, il TNFα attiva due enzimi, “MuRF-1” e “ATROGINA-1”, che causano catabolismo della massa muscolare scheletrica (Stenholm et al., 2008; Lipina et al., 2017).
Resistenza all’insulina
Le citochine proinfiammatorie, l’elevato rilascio di acidi grassi dal tessuto adiposo, la sintesi di grassi da parte del fegato (De Novo lipogenesi) e l’infiltrazione grassa nel muscolo scheletrico determinano resistenza all’insulina.
In tale condizione l’insulina non è in grado di esercitare i suoi effetti. Ecco perché si ricorre ai farmaci ipoglicemizzanti (esempio: metformina, insulina, etc.). Poiché l’insulina è anche un ormone anabolico, e cioè promuove sintesi proteica e crescita muscolare, il suo non corretto funzionamento determina perdita di massa muscolare (Stenholm et al., 2008).
L’allenamento di resistenza (allenamento pesi/bodybuilding) migliora la sensibilità all’insulina, regolarizza la glicemia e, quindi, favorisce aumento della massa muscolare.
Cortisolo
Nel grasso viscerale, e meno nel grasso sottocutaneo, è presente l’11B-HSD1. È un enzima che converte il cortisone inattivo in cortisolo; più aumenta il grasso viscerale più aumenta l’attività dell’11B-HSD1 (Bittolo, 2008). Più aumentano le citochine proinfiammatorie più aumenta l’attività dell’11B-HSD1 (Rao et al., 2016).
In poche parole se un soggetto è obeso ed infiammato allo stesso tempo, l’attività della 11B-HSD1 è più elevata di quella di un soggetto solo obeso o solo infiammato. Individui grassi ed infiammati producono più cortisolo di soggetti magri e questo comporta:
- resistenza all’insulina;
- perdita di massa muscolare;
- aumento della massa grassa.
Di rilievo è il fatto che l’enzima 11B-HSD1 è in grado di produrre la stessa quantità di cortisolo che produce il surrene (Stimson et al., 2013). Di nuovo, questo significa che essere obesi significa essere fortemente catabolici.
Ormoni
L’aumento del grasso viscerale e l’elevato livello di acidi grassi nel sangue inibiscono la secrezione di due importanti ormoni che favoriscono la crescita muscolare, GH e IGF-1. Bassi livelli di tali due ormoni sono stati associati a bassi livelli di forza muscolare. Inoltre, chi è obeso sarcopenico produce meno GH di chi è solo obeso (Stenholm et al., 2008). Anche l’analisi di questi fattori mette in risalto l’elevato potenziale catabolico dell’essere sovrappeso/obesi.
Adipochine
Il grasso viscerale secerne leptina, una adipochina che è responsabile della regolazione del peso corporeo ed altresì di soddisfare il senso di sazietà. Quando i livelli di grasso aumentano in modo importante, l’elevata secrezione di leptina si accompagna ad una condizione conosciuta come leptino-resistenza per la quale la stessa leptina non riesce più a svolgere in modo efficiente il suo ruolo biologico; vengono così disregolati i centri fame/sazietà, con conseguente aumento del consumo di cibo e relativo aumento di peso/ grasso corporeo.
Ma la leptina, in condizioni fisiologiche, è anche stimolatrice della secrezione di GnRH, contribuendo in tal modo al buon funzionamento dell’asse ipotalamo-ipofisi-testicoli e relativa fisiologica secrezione di testosterone. Al contrario, la leptino-resistenza, inibisce la secrezione di GnRH con relativa depressione dei livelli di testosterone. Allo stesso modo della leptino-resistenza agiscono IL-6 e TNFα sull’inibizione del GnRH.
La leptino-resistenza, inoltre, agisce anche a valle dell’asse ormonale deprimendo l’azione stimolatrice dell’LH sulla produzione testicolare di testosterone. In sintesi, l’aumento di grasso corporeo riduce i livelli di testosterone causando ulteriore accumulo adiposo con conseguente ed addizionale depressione dell’ormone sessuale maschile; si instaura un circolo vizioso che si autoalimenta (Kelly et al., 2013).
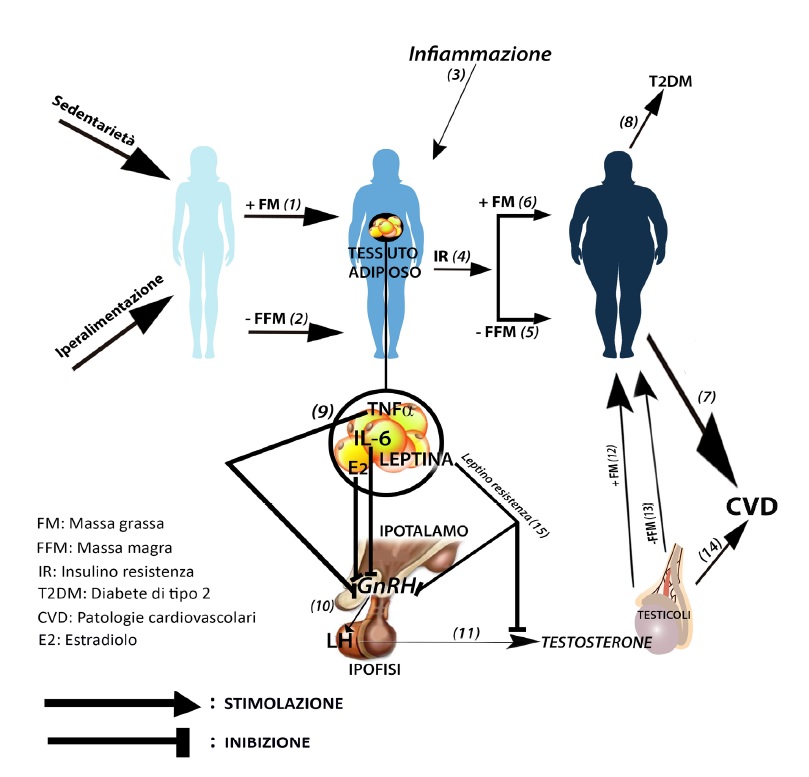
In figura un cluster di alterazioni metaboliche ed ormonali indotte da sedentarietà e iperalimentazione con risvolti patologici. Sedentarietà e iperalimentazione causano aumento di grasso corporeo (1) e perdita di massa magra (2). L’infiammazione del tessuto adiposo (3) genera insulino resistenza (4) e conseguente perdita di massa magra (5) e aumento della massa grassa (6). Tali condizioni predispongono alle patologie cardiovascolari (7) ed al diabete di tipo 2 (8). IL-6, TNFα, leptino-resistenza e estradiolo (9) generati dall’elevata adiposità viscerale inibiscono il GnRH ipotalamico. Seguono l’inibizione dell’LH (10) e del testosterone (11). Bassi livelli di testosterone inducono accumulo adiposo (12), catabolismo proteico (13) e predispongono alle patologie cardiovascolari (14). La leptino-resistenza blocca l’azione stimolatrice dell’LH sulla produzione di testosterone (15).